Secondo la legge di Snell i raggi di luce vengono rifratti tutti secondo lo stesso angolo e dovrebbero formare una circonferenza bianca. Invece Newton osservò il raggio di luce scomporsi in un insieme di colori detto spettro. Newton dedusse che la luce è composta da diverse componenti cromatiche rifratte in modo diverso dal prisma. Ogni colore ha un indice di rifrazione diverso.
Con la scoperta della natura ondulatoria della luce, il termine spettro venne riferito all'intensità della luce in funzione della lunghezza d'onda o della frequenza (colore della luce).
- spettro continuo (quello del corpo nero)
- spettro di emissione a righe (sorgente un gas rarefatto)
- spettro di assorbimento (luce che attraversa un gas)
SPETTRO A RIGHE E SPETTRI DI ASSORBIMENTO
Quello che caratterizza lo spettro di emissione e una serie di righe colorate su sfondo nero tipo un codice a barre. Nello spettro di assorbimento le righe sono nere su uno sfondo colorato. Nello stesso spettro solare è possibile individuare queste righe. La serie di righe caratterizzano in modo univoco il gas (elemento chimico) che ha emesso o ha assorbito la radiazione.Ogni linea corrisponde ad un elemento chimico. Dallo studio dello spettro è così possibile risalire alla composizione di una stella.
Nel 1802 Wollaston nota delle strane linee nere nello spettro solare. Nel 1814 un costruttore di lenti di nome Fraunhofer riuscì ad elencare più di 500 linee.
Intorno al 1850 Kirchhoff e Bunsen scoprono che lo stesso elemento che emette certe frequenze è anche capace di assorbire le stesse. Quindi lo spettro di emissione e spettro di assorbimento dello stesso elemento chimico sono complementari.
Nel 1885 Balmer, fisico appassionato di numerologia, giunse a tentativi alla semplice formula che fornisce la lunghezza d'onda delle righe visibili dello spettro dell'idrogeno:
con R=1,097x10^7 m−1
La formula precedente
dà la lunghezza d'onda maggiore, 656 nm, per n=3, e dà
le altre lunghezze d'onda minori quando n arriva fino a 6. Infatti al crescere di n diminuisce 1/n² e quindi diminuisce la lunghezza d'onda e di conseguenza ci spostiamo verso il violetto. Inoltre al crescere di n le linee tendono a addensarsi verso il limite di 365 nm.
Non tutte le righe di emissione di un atomo di idrogeno sono descritte
dalla serie di Balmer. Vi sono righe anche nell'ULTRAVIOLETTO che non è visibile e sono descritte dalla FORMULA DI LYMAN:
Mentre nell'INFRAROSSO vale la FORMULA DI PASCHEN
PERCHE' l'idrogeno e tutti gli altri gas se eccitati emettono spettri a righe e non uno spettro di emissione continuo?
Il motivo è strettamente legato al modello atomico di Bohr. Ed proprio il fisico danese Bohr che riesce a spiegare lo spettro a righe proponendo un nuovo modello di atomo quantistico.
Secondo Bohr la frequenza precisa di ciascuna linea spettrale corrisponde all'energia di un salto quantico tra due livelli energetici di un certo atomo.
Un elettrone posto in un livello eccitato Ei ritorna spontaneamente ad un livello più stabile Ef ed EMETTE un fotone di energia hf uguale alla differenza delle energie dei due livelli: Ei-Ef.
Quindi l'atomo di un certo elemento è capace di emettere solo
determinate frequenze discrete e questo spiega le linee di emissione
dello spettro.
Viceversa un elettrone può passare da un livello meno eccitato Ei ad uno più eccitato Ef solo se ASSORBE l'energia di un fotone e questo avviene solo se la frequenza del fotone e tale che hf=Ei-Ef.
Quindi l'atomo è capace di assorbire solo determinate frequenze e
questo spiega le righe di assorbimento dello spettro di un elemento.
Quindi la frequenza di ciascuna linea spettrale corrisponde all'energia di un SALTO QUANTICO tra due livelli energetici di un certo atomo. Se l'atomo è in un gas particolarmente CALDO (es: neon) gli elettroni sono in uno stato eccitato e tendono a tornare su orbitali più stabili perdendo energia ed emettendo fotoni con energia hf=Ei-Ef.(SPETTRO DI EMISSIONE).
Come mostrato in figura ad ogni serie di righe corrisponde lo stato stazionario di arrivo. Nell'atomo di idrogeno gli elettroni che tornano al secondo orbitale formano la serie di Balmer mentre quelli che tornano al primo orbitale formano quella di Lyman. Maggiore è il salto, maggiore è l'energia emessa e quindi uno spostamento verso il violetto. GAS più freddi invece assorbono energia da una sorgente luminosa e spingono un elettrone in un livello più alto; ne risulta una linea di assorbimento scura nello spettro della sorgente retrostante.
Al posto del prisma per separare le diverse componenti della radiazione si possono usare i reticoli di diffrazione composti da una fila di fenditure parallele.
con :
è l'angolo di diffusione che è maggiore per radiazioni con maggiore lunghezza d'onda (es. rosso)










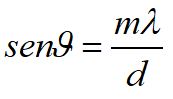
Nessun commento:
Posta un commento