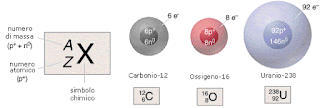
COME è FATTO L'ATOMO?
Il video ripercorre brevemente l'evoluzione storica del modello atomica da Democrito arrivando ai giorni nostri (ITA)
DEMOCRITO (IV sec. A.C.): Prima idea di atomo come componente elementare e indivisibile della materia. (atomismo)
MODELLO ATOMICO "A PANETTONE" :
Nel 1897 il fisico inglese J.J.Thomson studiando la natura dei raggi catodici scopre l'elettrone e misura il suo rapporto carica massa. (vedi esperimento). La massa dell'elettrone m=9,1x10⁻³¹ Kg risultava migliaia di volte più piccola di quella dell'atomo. Inoltre l'atomo risultava elettricamente neutro e formato da cariche che emettono
onde elettromagnetiche. Intorno al 1907, Thomson propose un modello atomico detto "a panettone" dove le uvette erano gli elettroni immersi e sparpagliati nella grande carica positiva dell'atomo (il panettone).
onde elettromagnetiche. Intorno al 1907, Thomson propose un modello atomico detto "a panettone" dove le uvette erano gli elettroni immersi e sparpagliati nella grande carica positiva dell'atomo (il panettone).
MODELLO PLANETARIO DI RUTHERFORD
Intorno al 1908 il fisico neozelandese Rutherford utilizza particelle alfa (nuclei di elio formati da 2 protoni e 2 neutroni con carica positiva +2e) per bombardare una lamina d'oro. Su uno schermo posto intorno alla lamina si osservavano le scintillazioni prodotte dalle particelle alfa diffuse.
Nell'esperimento molte particelle alfa superavano l'ostacolo praticamente indisturbate mentre alcune venivano deflesse a volte con angoli molto grandi. Alcune particelle tornavano addirittura indietro.
Nell'esperimento molte particelle alfa superavano l'ostacolo praticamente indisturbate mentre alcune venivano deflesse a volte con angoli molto grandi. Alcune particelle tornavano addirittura indietro.
con questa simulazione si può ripetere l'esperimento
Questi fatti non si accordavano con il modello "a panettone"
Rutherford capì che l'atomo era in gran parte VUOTO (e questo spiegava il passaggio di molte particelle ) e che dentro l'atomo vi era un NUCLEO piccolo dotato di grande massa e di carica POSITIVA capace di far deviare le particelle alfa. Dalla deviazione subita dalle particelle alfa, Rutherdorf riesce a determinare le dimensioni del nucleo: r=5x10⁻¹⁵ m
Ne consegue un nuovo modello dell'atomo detto modello PLANETARIO formato da un nucleo centrale con carica positiva +N⋅e (dove e è la carica dell'elettrone e N è il numero di elettroni). Nel nucleo è concentrata tutta la massa. N elettroni ruotano intorno al nucleo per effetto dell'attrazione elettrostatica.
Inoltre ogni elemento chimico era caratterizzato da un particolare valore di N. Per l'idrogeno N=1 per l'elio N=2 ecc.
PROBLEMI del modello planetario: Gli elettroni per effetto della rotazione sono accelerati e come è noto una carica accelerata genera onde elettromagnetiche. Così secondo il modello planetario l'elettrone avrebbero dovuto perdere energia irradiando onde elettromagnetiche e l'atomo sarebbe così risultato instabile. Quindi secondo la teoria dell'elettromagnetismo gli elettroni avrebbero dovuto collassare sul nucleo.
ATOMO DI BOHR (interpretazione quantistica): Nel 1913 il fisico danese Niels Bohr risolse il problema fornendo un'interpretazione quantistica. Le ipotesi sono:
1) esistono orbite stabili associate ad una determinata energia dove l'elettrone può girare senza irradiare.
2) la transizione dell'elettrone da un'orbita di energia E1 ad un'orbita di energia E2 avviene solo per assorbimento o emissione di un quanto di energia hf=|E1-E2|
3)anche il momento angolare L dell'elettrone è quantizzato cioè può essere solo multiplo intero di una certa quantità :
I RAGGI CATODICI
video ESPERIMENTO DI RUTHERFORD
Video documentario su Bohr e il suo modello atomico - 2 parte
stabilità dell'atomo
Video documentario su Bohr e il suo modello atomico - 2 parte